2019年至今,中国已获批的儿科药数量超200个,且获批数量逐年递增,2019-2022年四年间获批上市的儿科药数量分别为19、26、47、66个,而今年以来已有近50个儿科药获批,进一步缓解儿童适宜剂型少、规格少等问题。
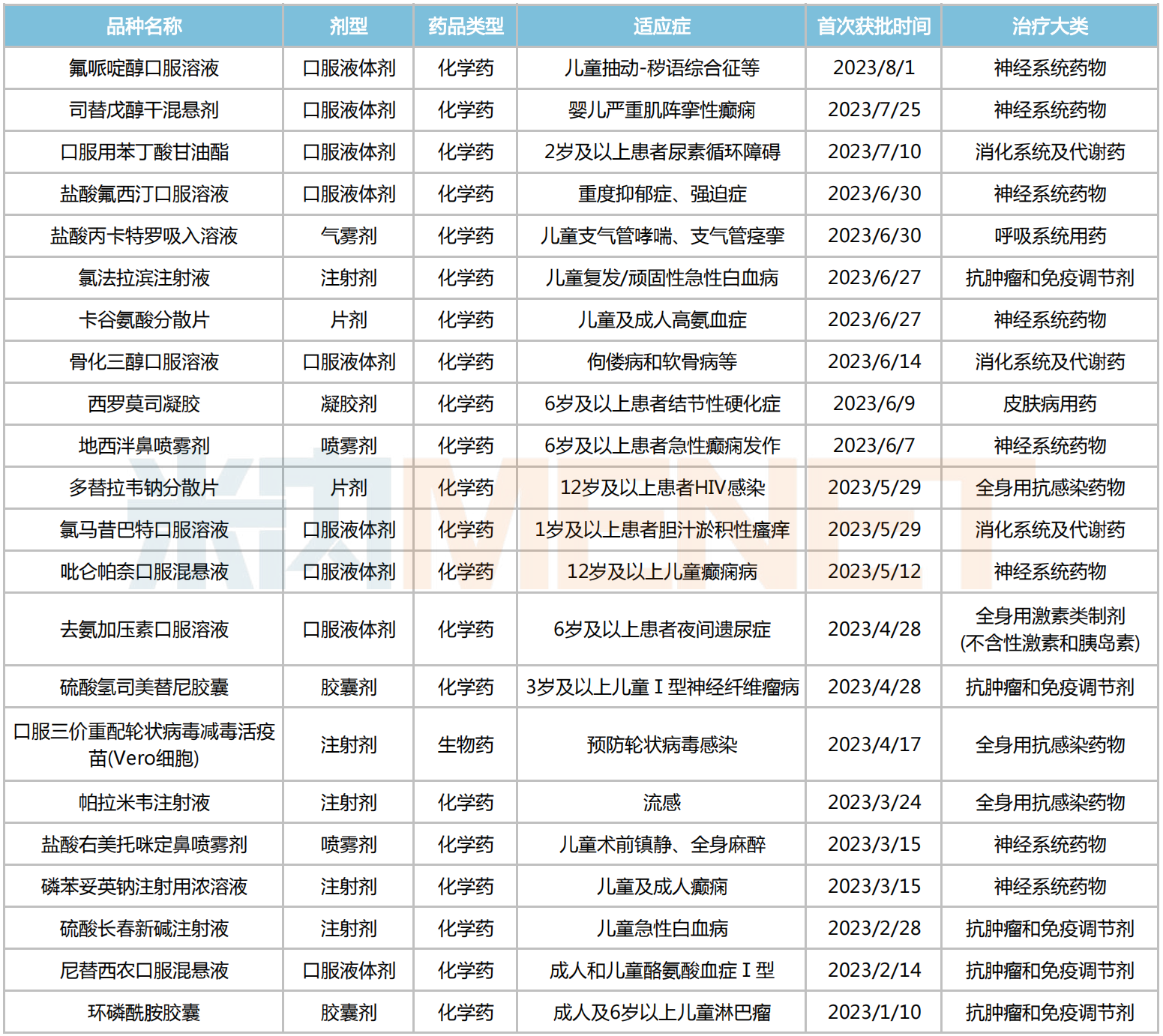
据不完全统计,近50个今年获批的儿科药中,约有22个品种为首次获批上市,其中口服液体剂占比接近四成,满足儿科用药便利性的需求;治疗大类上以神经系统药物、抗肿瘤和免疫调节剂居多,分别有8个和5个品种进账,消化系统及代谢药、全身用抗感染药物等用药领域则各有3个新品诞生。
恒瑞医药的环磷酰胺胶囊属于广谱抗肿瘤药,适用于6岁及以上儿童和成人的恶性淋巴瘤、霍奇金淋巴瘤等多种肿瘤治疗;据悉,25mg的环磷酰胺口服制剂因符合儿童的生理特征和用法用量特点,在上述儿童疾病的治疗中更为适用,具有明显的临床价值。
合肥亿帆生物的氯法拉滨注射液同为儿科抗肿瘤药,用于儿童难治性/复发性急性淋巴细胞白血病,是多年来国内少有的获批用于儿童用白血病药物,属于临床急需品种。
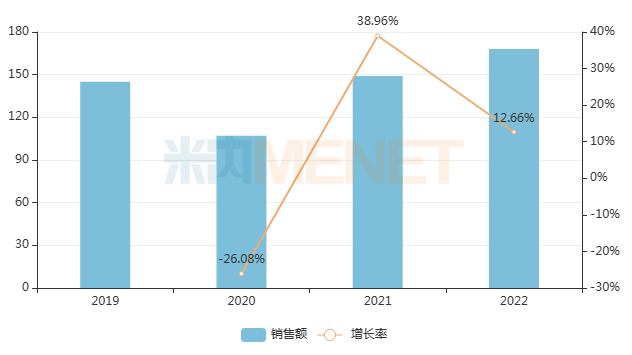
帕拉米韦注射液是一款主治甲流、乙流等流行性病毒感染类药物,相较于奥司他韦等口服制剂,注射剂更便于治疗无法完成自我吞咽的低龄患儿;今年以来,已有扬子江药业、齐鲁制药、中润药业等6家企业的产品获批生产,并视同过评。在此之前,本品另一制剂——帕拉米韦氯化钠注射液已于2018年3月获批上市,数据显示,2022年该药在中国公立医疗机构终端销售额超5亿元,同比增长27%。
司替戊醇干混悬剂是由石四药开发的一款儿科罕见病药,用于治疗婴儿期严重肌阵挛性癫痫综合征(Dravet综合征)患者全身僵直性癫痫发作。Dravet综合征是一种罕见的难治性癫痫性脑病,已被纳入2018年发布的《第一批罕见病目录》。
02、19款儿科药剑指新国谈 独家品种“霸屏”
为了让更多患儿用上“质优价廉”的儿科药,推进其加快准入医保成为国家的重要任务之一。
日前,国家医保局公布“2023国家医保目录通过形式审查名单”,390个
药品(包括348个西药和42个中成药)跨过国谈初审“门槛”,通过药品数创下历史之最。
此外,新一轮国谈重点继续向罕见病药、儿科药等药品倾斜,多款1类新药、罕见病药、鼓励开发的儿科药及仿制药位列其中。
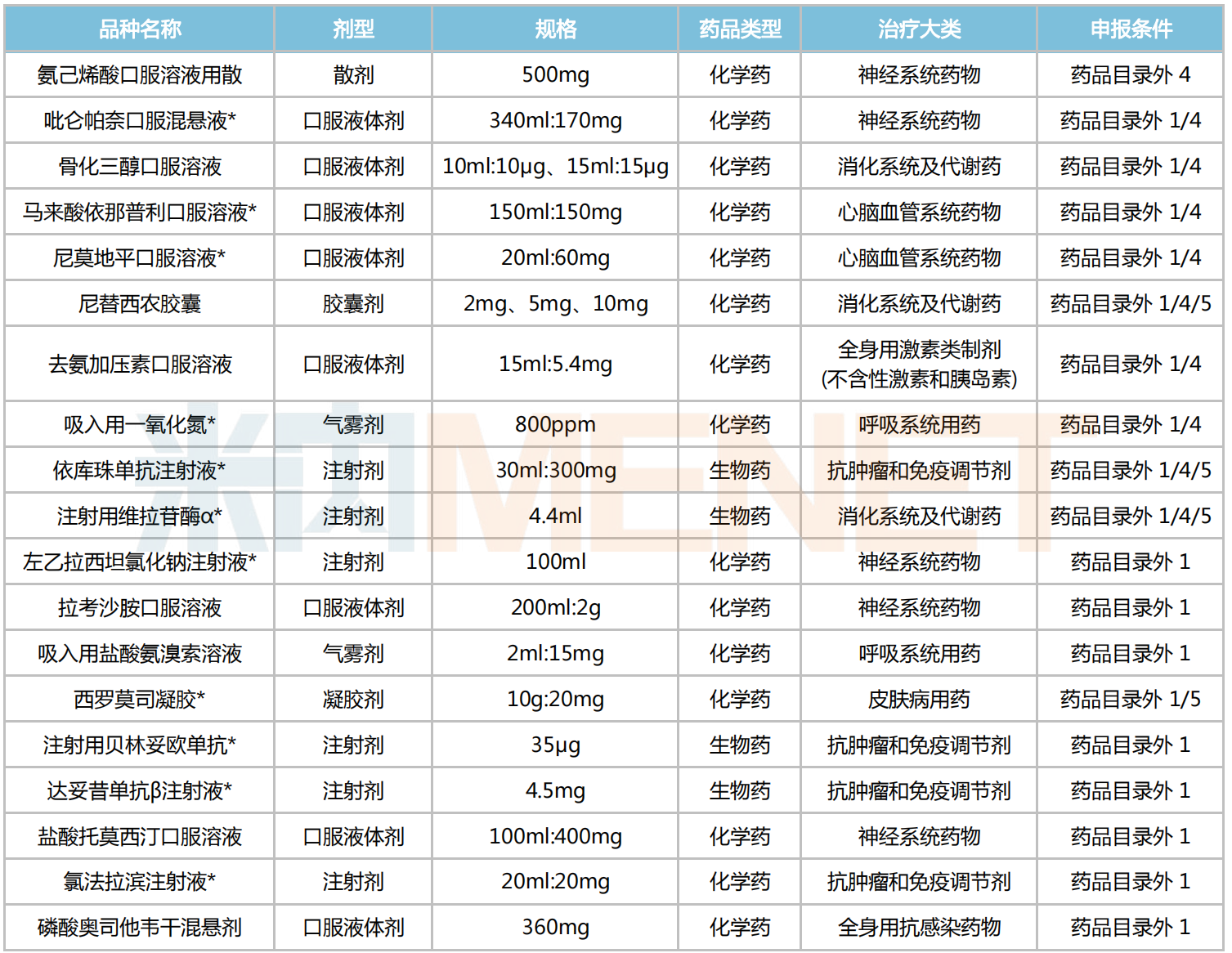
儿科药方面,有19个医保目录外药品通过形式审查,其中化学药15个、生物药4个;剂型上以口服液体剂为主,有8个品种上榜;治疗大类上看,神经系统药物占据5个席位,抗肿瘤和免疫调节剂(4个)、消化系统及代谢药(3个)、呼吸系统用药(2个)、心脑血管系统药物(2个)分别位居其后。
医保目录外通过形式审查的儿科药
注:带*为独家品种
19个目录外的儿科药中,有5个新品在今年获批,包括骨化三醇口服溶液、去氨加压素口服溶液等;独家品种占比近六成,有11个。
恒瑞
医药的尼莫地平口服溶液用于颅内囊性动脉瘤破裂的蛛网膜下腔出血,而口服液体剂具有剂量灵活和易于吞咽等特点,尤其适用于老年人以及儿童群体,2016年该药被纳入第一批鼓励研发申报儿科药名单。四川百利药业的马来酸依那普利口服溶液为第三批鼓励研发申报儿科药名单品种,也是国内首个儿童专用的血管紧张素转化酶抑制剂(ACEI)口服溶液,若该药能顺利进保,将进一步提高各年龄段
高血压、心力衰竭以及肾脏疾病患儿的用药可及性。
吸入用一氧化氮是兆科药业旗下的一款血管扩张剂,可用于改善脆弱新生儿群体的氧合;2020年1月,该药被CDE以“治疗儿科罕见病”为由纳入优先审评,随后于2022年3月获批上市,是全球首款获批的医用NO气体。依库珠单抗注射液由阿斯利康开发,于2018年9月引进国内,用于治疗成人/儿童阵发性睡眠性血红蛋白尿症(罕见病:PNH)和非典型溶血性尿毒症综合征(罕见病:aHUS)。武田药品的注射用维拉苷酶α同属儿科罕见病药,主要用于1型戈谢病患者的长期酶替代治疗;据悉,该药在治疗早期即可改善患儿的贫血、血小板减少等症状,并在后期持续改善或稳定其生长发育情况......
根据2023国谈工作安排,通过初步形式审查的药品将相继进入专家审评、谈判竞价、公布结果及形成目录等环节。最终,哪些药品能成功入选,3个月后有望见分晓。
03、激励政策层出不穷 助推儿科药创新研发
作为特殊的用药群体,儿童有自己独特的生理特点,而目前儿科药市场供应仍呈现品种少、剂型少、规格少、特药少的“四少”现状。另一方面,儿科药研发生产也面临政策
法规起步晚、研发成本高、临床试验难推进、定价机制无明显优势等诸多挑战。
对此,今年以来国家已陆续出台多项儿科药相关政策,合力为
企业创新研发提供新思路。
2023年1月,国家卫健委发布《关于进一步加强儿童临床用药管理工作的通知》,鼓励医疗机构针对儿童用药开发可灵活调整剂量的新技术、新方法;随后3月,国家药监局发布《儿童抗肿瘤药物临床研发技术指导原则》,为儿童抗肿瘤新药的临床研发提供技术建议;紧接着4月,CDE发布《儿童用药沟通交流中Ⅰ类会议申请及管理工作细则(试行)》,更好地指导和服务儿科药研发;同年8月,国家卫健委公布《第四批鼓励研发申报儿童药品清单》,共涵盖吉妥珠单抗注射剂、左甲状腺素钠口服溶液剂、非诺多泮注射剂等24个临床急需儿科药......
今年以来国家发布的鼓励儿科药研发相关政策
中国是全球第二大儿科用药市场,根据国家统计局的数据,2020年0-14岁少儿人口数为2.53亿人,约占全国总人口数的18%。随着国家“三胎”等政策全面放开,儿科用药需求也随之增加。预计在相关政策和用药需求的驱动下,未来儿科药市场将迎来巨大的发展机遇。
来源:米内网数据库、国家医保局等
注:上述销售额以产品在终端的平均零售价计算。数据统计截至8月25日,如有疏漏,欢迎指正。